全国加强第二类医疗器械注册管理工作会议在成都召开。会议通报了境内第二类医疗器械注册清理规范及相关品种整改情况,就全面加强注册管理有关工作作出部署。国家药监局党组成员、副局长徐景和出席会议并讲话。会议要求,要全面强化境内第二类医疗器械审评审批工作。要坚持人民至上,树牢监管为民理念;坚持依法行政,严格规范审评审批;坚持源头治理,严格首个产品上市审批;坚持系统思维,加强质量管理体系建设,切实保障人民群众用械安全。

2021年12月,湖南省药监局为规范医疗器械/体外诊断试剂注册管理,组织制定第二类医疗器械/体外诊断试剂注册业务流程,自2022年1月1日起施行。和传统流程相比时限缩短50%。

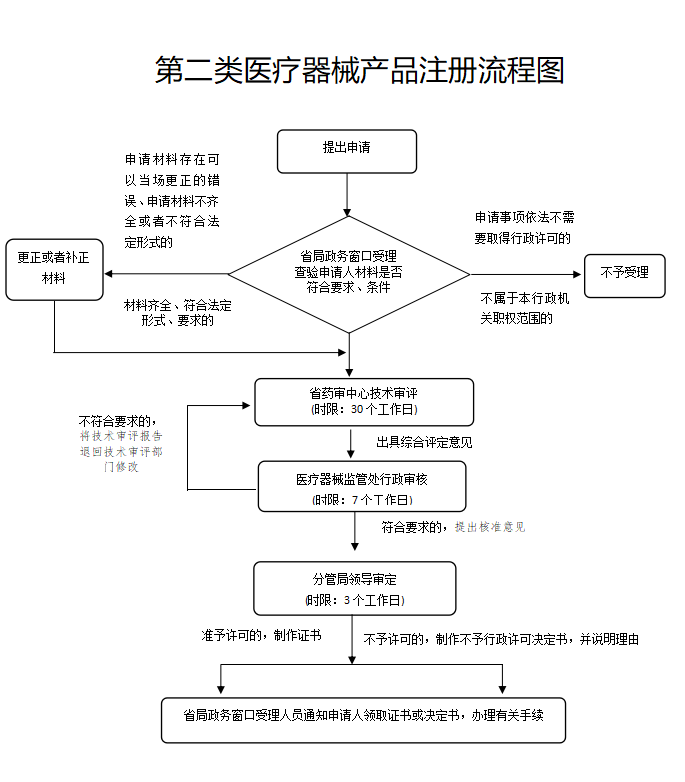
技术审评时限:仅为30个工作日,包括发补审评。如果是特别快审只需要5个工作日。
质量管理体系核查:可以合并至生产许可现场检查时进行的,也就是说可以先拿注册许可证,再进行体系核查。
行政审核时限:7个工作日,快审只需要3个工作日。
行政审定时限:3个工作日(实施特别快速审批的为2个工作日)
制证时限:3个工作日(制证时限不计入总时限)
总时限:40个工作日(实施特别快速审批的为10个工作日,不包含补充资料、专家审评和体系核查时间)
法定时限:80个工作日
缩短时限:50%
2022年12月14日重庆市药品技术审评查验中心和大渡口区大健康生物医药产业发展办公室,发布通知!决定在大渡口区试点开展医疗器械产品注册审评前置服务工作。据悉大渡口区医疗器械放管服服务中心(以下简称“服务中心”)2名专员负责接件,重庆市医疗器械技术审评查验服务站(以下简称“服务站”),由市药监局统一调派5名技术审评专业人员入驻服务站,为大渡口区第二类医疗器械注册申请人,根据相关服务内容要求提供产品注册审评前置服务。专业而充足的服务保障团队,平均提升注册时间3-4个月以上,最快实现一周拿证。
近些年随着各省药监局陆续出台了一系列优化注册流程,缩短注册时间的措施,并以此作为吸引IVD相关企业落户及入驻园区,这类措施有助于行业快速发展,但在一手提速度的时候,一手也要把好质量关,坚持系统思维,加强质量管理体系建设,切实保障人民群众用械安全。
来源:IVD从业者网、国家药监局,湖南省药监局、重庆市药品技术审评查验中心等